

Le métabolisme cellulaire La glycolyse
Informations générales
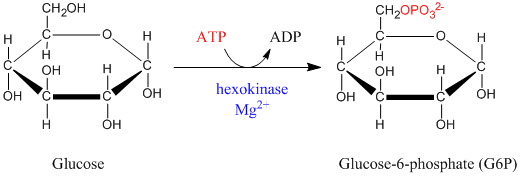
La phosphorylation du glucose est la première étape de la glycolyse. Cette réaction, irréversible, a pour but le transfert d'un groupement phosphoryle sur le glucose à partir d'ATP, aboutissant à la formation de glucose-6-phosphate (G6P). Elle est catalysée par une kinase pouvant être de deux natures selon le type cellulaire; l'hexokinase pour les cellules musculaires principalement et la glucokinase pour les cellules du foie ainsi que les cellules b du pancréas. Ces enzymes ne convergent pas vers la même voie métabolique. Dans tous les cas, l'enzyme intervenant est Mg2+ dépendante, celui-ci complexant l'ATP. En effet, l'ATP non complexé est un puissant inhibiteur compétitif.
Hexokinase vs Glucokinase
Légende : Variation de l'activité de l'hexokinase et de la glucokinase dans la réaction de phosphorylation du glucose en fonction de l'augmentation de la glycémie.
|
Mécanisme
Nous n'aborderons ici que le mécanisme orchestré par l'hexokinase. La présentation du mécanisme se déroulera en trois étapes à savoir:
Une puissante stabilisation du glucose, dans le site actif, est engendrée par pas moins de 9 liens hydrogènes (~14kJ/mol). Les acides aminées intervenant dans la formation de ces liens sont : la Thréonine 168 (Thr), la Lysine 169 (Lys), l'Asparagine 204 (Asn), l'Aspartate 205 (Asp) et le Glutamate 256 (Glu). L'Aspartate 205 est le seul acide aminé de l'enzyme impliqué dans le mécanisme réactionnel.
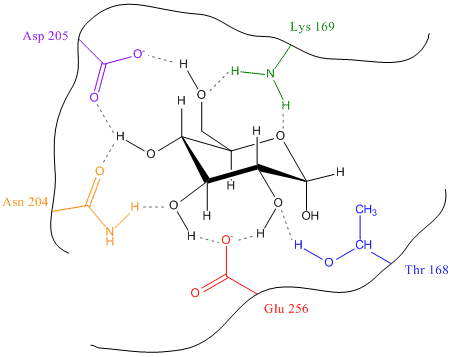
Légende : Représentation schématique de la stabilisation du glucose
la poche catalytique de l'hexokinase.
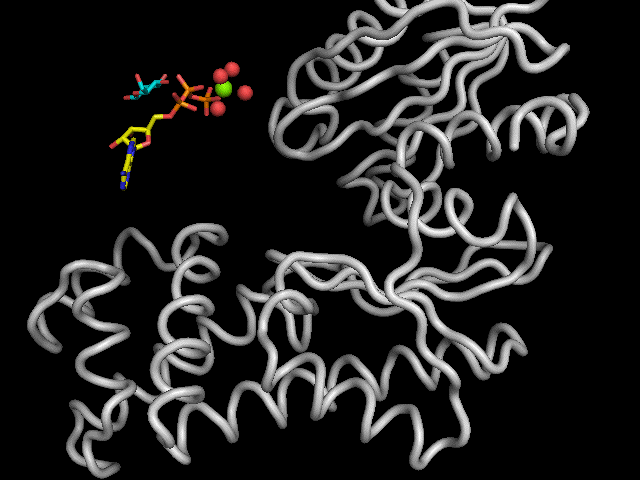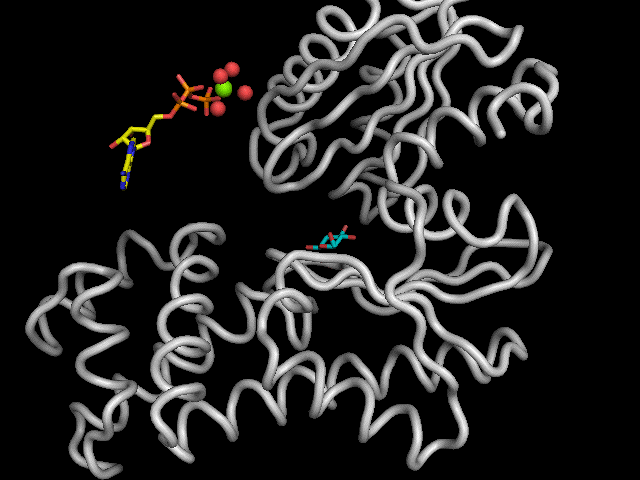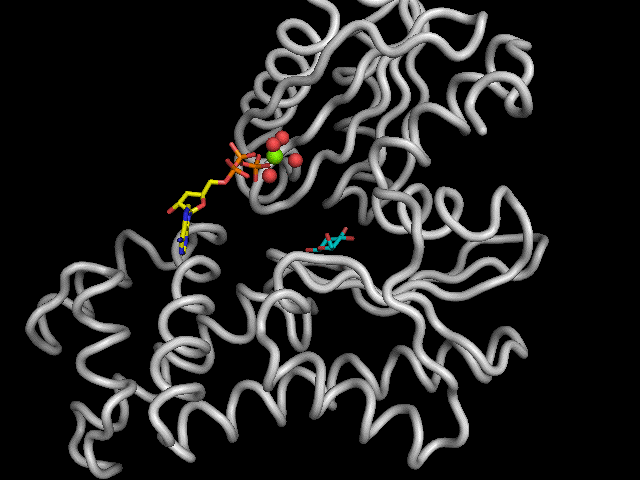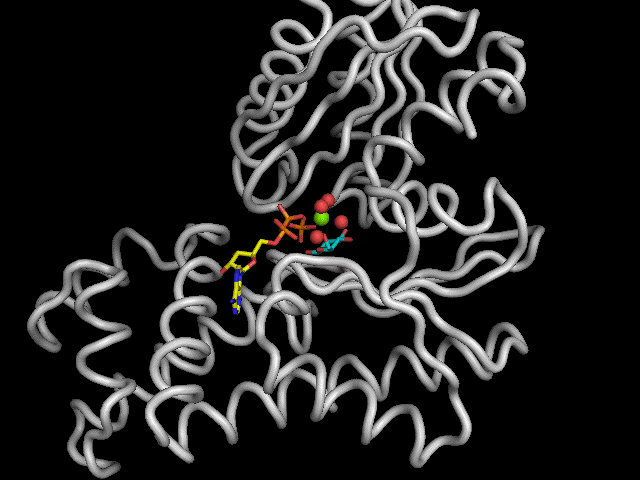
|
Une importante question de mécanisme se pose : Pourquoi l'hexokinase catalyse-t-elle le transfert d'un groupement phosphoryle de l'ATP au glucose pour donner du G6P et non à l'eau pour donner de l'ADP + Pi ? La molécule d'eau est
certainement bien assez petite pour pouvoir s'insérer dans le site
enzymatique impliqué dans la liaison du groupement phosphoryle. De plus, le
transfert du groupement phosphoryle de l'ATP à l'eau est plus exergonique
que le transfert au glucose. Remarque : Si le groupement catalytique et les réactifs se trouvaient en bonne position pour qu'il y ait réaction, alors que l'enzyme est en conformation ouverte, l'hydrolyse de l'ATP serait certainement la réaction prédominante. |
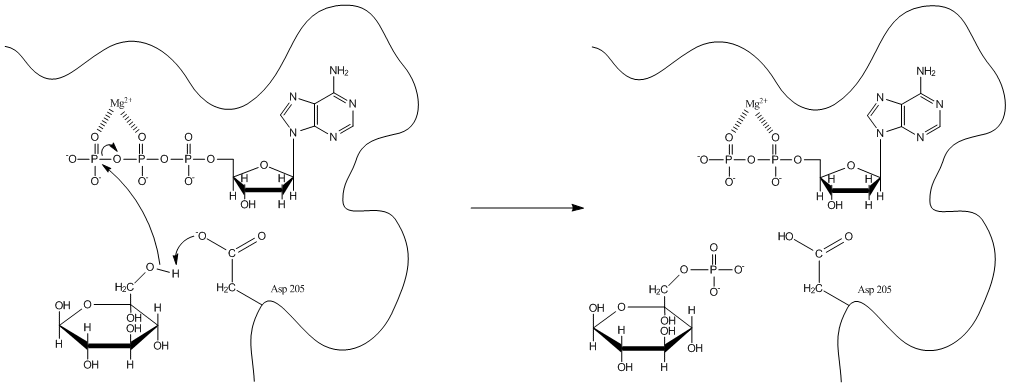
Légende : Mécanisme réactionnel de l'enzyme.
L'hexokinase présente un mécanisme "Bi Bi aléatoire". Les enzymes catalysant des réactions entre deux substrats et devant passer par les formations de deux complexes (enzymes-substrat A et enzyme-substrat A-substrat B), suivent un mécanisme nommé "Bi Bi". Si l'ordre de formation de complexe n'est pas imposé, nous parlerons alors de mécanisme "Bi Bi aléatoire".
Le moteur de la réaction est le résidu Aspartate 205 qui sert de base pour déprotoner l'hydroxyle cité précédemment. Le doublet d'électrons de l'oxygène ainsi libéré, réalise une attaque nucléophile sur le phosphore du groupement phosphoryle g de l'ATP. Cela engendre la formation d'une liaison covalente entre le glucose et le groupement phosphoryle avec libération d'ADP et de G6P.
Sources
"BIOCHIMIE, D. Voet et J. G. Voet, de boeck 2005 ISBN: 2-8041-4795-9 .
http://www.chem.ucsb.edu/~molvisual/ABLE/induced_fit/index.html
http://www.wellesley.edu/Chemistry/chem227/glycolysis/glycolysis.htm
Le métabolisme cellulaire La glycolyse